Электролитическая диссоциация
Тема. Химические реакции. Электролитическая диссоциация кислот, щелочей и солей в водных растворах. Методическая разработка урока по теме: «Электролитическая диссоциация» составлена по программе О. С. Габриелян «Химия 8 класс».
Автор: Гомулина Н.Н.
Тип урока. Комбинированный урок.
Цель урока. Дать представление учащимся о современных представлениях об электролитической диссоциации, электролитах и неэлектролитах. Рассмотреть механизм диссоциации веществ с различным типом связи. Познакомить со степенью электролитической диссоциации и классификацией электролитов.
Основные понятия. Электролитическая диссоциация, электролиты, неэлектролиты, степень диссоциации.
Мировоззренческий аспект урока. Формирование научного мировоззрения о химических реакциях.
Межпредметные связи на уроке.
- Физика: атом, строение атома, электрический ток в электролитах.
Использование новых информационных технологий: Использование интерактивной доски и объектов курса серии «Открытая коллекция» «Химия, 8–9 классы» (Windows, Linux): интерактивные модели «Растворение хлорида натрия», «Реакция нейтрализации и электропроводность», интерактивные задания в параметризованном виде.
Компетентности учащихся. Знать определение, понятие, степень электролитической диссоциации; сильные и слабые электролиты; основные положения ТЭД, определение кислот, оснований и солей на основе ТЭД.
План урока
|
Этапы урока
|
Время, мин
|
Приемы и методы
|
|
I. Организационный момент. Актуализация знаний.
|
1
|
Беседа с учащимися
|
|
II. Демонстрационный эксперимент
|
10
|
Проведение демонстрационного эксперимента и его обсуждение
|
|
III. Изучение нового материала
|
15
|
Сообщение учителя и использованием интерактивных моделей
|
|
IV. Обобщение знаний. Формирование умений и навыков.
|
4
|
Краткий опрос учащихся по новому материалу
|
|
V. Первичная проверка усвоения знаний. Рефлексия
|
14
|
Работа с тестами
|
|
V. Домашнее задание
|
1
|
Комментарии учителя по домашнему заданию
|
I. Организационный момент. Актуализация знаний
II. Демонстрационный эксперимент
Проведение демонстрационного эксперимента «Сравнение электропроводности воды и растворов соли и кислоты». Рекомендуется проводить данный опыт по книге «Демонстрационный эксперимент по физике», часть 2, стр. 204, выбрать лампочку мощностью 36 В, но достаточно большую, чтобы было видно со всех рядов класса.
Вывод по эксперименту: Все вещества по их способности проводить электрический ток в водных растворах можно разделить на два типа:
- Электролиты – вещества, растворы которых проводят электрический ток.
- Неэлектролиты – вещества, растворы которых не проводят электрический ток.
Можно также рассказать о современных приборах – кондуктометрах, определяющих концентрацию растворов кислот, оснований, солей.


Проведение демонстрационного эксперимента «Зависимость электропроводности растворов от концентрации»
Вывод по эксперименту: Электролитическая диссоциация – распад вещества на ионы под действием полярных молекул растворителя.
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 80-х гг. XIX в.
Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого происходит диссоциация электролита на ионы.
III. Изучение нового материала
Рассматривается механизм диссоциации веществ с различным типом связи. Диссоциация веществ с ионным типом связи происходит в три стадии:
- ориентация молекул – диполей воды около ионов кристалла;
- гидратация (взаимодействие) молекул воды с противоположными ионами поверхностного слоя кристалла;
- диссоциация (распад) кристалла электролита на гидратированные ионы.
Диссоциация веществ с ковалентной полярной связью:
- ориентация молекул воды вокруг полюсов молекулы электролита;.
- гидратация (взаимодействие) молекулы воды с молекулами электролита;
- ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
- диссоциация (распад) молекул электролита на гидратированные ионы.
Сильные электролиты – при растворении в воде практически полностью диссоциируют на ионы. Степень диссоциации таких электролитов близка к единице. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью.
Слабые электролиты – при растворении в воде почти не диссоциируют на ионы.
Классическая теория электролитической диссоциации применима лишь к разбавленным растворам слабых электролитов. Сильные электролиты в разбавленных растворах диссоциированы практически полностью.
Определение кислот, оснований и солей на основе ТЭД.
Рекомендуется использовать модели:

Модель «Растворение хлорида натрия».
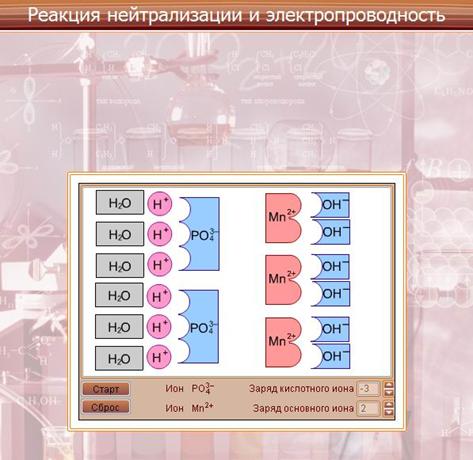
Модель «Реакция нейтрализации и электропроводность».
IV. Обобщение знаний. Формирование умений и навыков
1. Какой вклад в развитие теории электролитической диссоциации внес С.Аррениус?
Ответ: сформулировал основные положения теории электрической диссоциации.
2. Какие вещества называются электролитами? Вещества, которые проводят электрический ток или вещества, водные растворы или расплавы, которых проводят электрический ток? Ответ: вещества, водные растворы или расплавы, которых проводят электрический ток.
3. Что называется сильными (слабыми) электролитами?
V. Первичная проверка усвоения знаний. Рефлексия
Для проверки усвоения знаний рекомендуется использовать тесты. Тестирование можно проводить неоднократно по одним и тем же вопросам, так как тестовые задания параметризованы.



Литература:
1) Габриелян О.С. Химия.8. - М.: Дрофа, 2005. С.94-95.
2) Демонстрационный эксперимент по физике. Под ред. А.А.Покровского. М., 1972 г. т.II. С. 204 – 205.
3) Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 8 класс. – Москва. Дрофа. 2002.
4) Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия. 9 класс. – Москва. Дрофа. 2002.