Химия. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Тема. Современная формулировка периодического закона и современное состояние периодической системы химических элементов Д. И. Менделеева.
Автор: Гомулина Н.Н.
Тип урока. Комбинированный урок.
Цель урока. Дать представление учащимся о современных представлениях о Периодическом законе и Периодической системе химических элементов Д. И. Менделеева.
Закрепить знания учащихся о взаимосвязи между положением элемента в периодической системе и строением атома.
Основные понятия. Химический элемент. Классификация элементов по электронным структурам их атомов. Период. Группа. Периодичности в периодичной системе. Электронная структура атомов.
Мировоззренческий аспект урока. Формирование научного мировоззрения в ходе знакомства с периодической системой Д. И. Менделеева.
Межпредметные связи на уроке.
- Физика: атом, строение атома.
Использование новых информационных технологий: Использование интерактивной доски и интерактивной модели «Периодическая система элементов» курса серии «Открытая коллекция» «Химия, 10–11 классы» (Windows, Linux)
План урока
|
Этапы урока
|
Время, мин
|
Приемы и методы
|
|
I. Организационный момент. Актуализация знаний.
|
1
|
Беседа с учащимися
|
|
II. Сообщения учащихся о работах предшественников Д.И. Менделеева
|
10
|
Сообщение учащихся, подготовленные заранее
|
|
III. Изучение нового материала
|
15
|
Сообщение учителя и использованием интерактивной модели «Периодическая система элементов»
|
|
IV. Обобщение знаний. Формирование умений и навыков.
|
8
|
Краткий опрос учащихся по новому материалу
|
|
V. Первичная проверка усвоения знаний. Рефлексия
|
10
|
Работа с тестами, с использованием интерактивной модели «Периодическая система элементов»
|
|
V. Домашнее задание
|
1
|
Комментарии учителя по домашнему заданию
|
Методические указания.
Современная формулировка периодического закона и современное состояние периодической системы химических элементов Д. И. Менделеева. Периодические свойства элементов (атомные радиусы, энергия ионизации) и образованных ими веществ.
I. Организационный момент. Актуализация знаний
II. Сообщения учащихся о работах предшественников Д. И. Менделеева
Учащиеся в краткой форме (не более 2 минут) представляют подготовленные заранее сообщения о предшественниках Д. И. Менделеева: классификация Й. Я. Берцелиуса, триады И. В. Деберейнера, спираль А. Бегье де Шанкуртуа, октавы А. Р. Ньюлендса и классификация Л. Майера.
Обобщение учителем: До Д. И. Менделеева было предпринято около 50 попыток классифицировать химические элементы. Большинство ученых пытались выявить связь между химическими свойствами элементов и их соединений и атомной массой.
III. Изучение нового материала
Д. И. Менделеев выделил периоды, в которых свойства химических элементов и образованных ими веществ закономерно изменяются (учебник «Химия» 11 класс О. С. Габриелян, Г. Г. Лысова).
1. Металлические свойства простых веществ, наиболее ярко выраженные у щелочных металлов, ослабевают и сменяются не металлическими, которые наиболее ярко выражены у галогенов.
2. Значение степени окисления атомов элементов в высших оксидах возрастает от +1 до +7 (+8 только для Os и Ru).
3. Значение степени окисления атомов элементов в гидридах (соединениях металлов с водородом) и в летучих водородных соединениях возрастает сначала от +1 до +3 и затем от –4 до –1. Например:
|
+1
|
+2
|
+3
|
–4
|
–3
|
–2
|
–1
|
|
LiH →
|
BeH2 →
|
BH3 →
|
CH4 →
|
NH3 →
|
H2O →
|
HF
|
4. Основные оксиды элементов начала периода сменяет амфотерный оксид и далее – кислотные, свойства которых усиливаются:
|
Na2O → MgO→
|
Al2O3 →
|
SiO2→
|
P2O5 → SO3→
|
Cl2O7 →
|
|
основные оксиды
|
амфотерный оксид
|
|
кислотные оксиды
|
|
|
|
|
|
|
|
5. Гидроксиды-основания через амфотерный гидроксид сменяются все более сильными кислотами. Например:
|
NaOH →
|
Mg(OH)2 →
|
Al(OH)3 →
|
Н2SiO3 →
|
Н3РО4 →
|
H2SO4 →
|
HClO4
|
|
щелочь
|
основание
|
амфотерный гидроксид
|
слабая кислота
|
кислота средней силы
|
сильная кислота
|
очень сильная кислота
|
Периодическая система Менделеева – это естественная классификация элементов по электронным структурам их атомов.
Современная формулировка периодического закона гласит: «Свойства элементов находятся в периодической зависимости от зарядов ядер их атомов». Это обстоятельство отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп.
Электронная модель легко позволяет выделить группы и периоды.
Структура электронной оболочки атомов элемента изменяется периодически с ростом порядкового номера элемента.
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Период – горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов. Номер периода обозначает число энергетических уровней в атоме элемента. Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
В зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Первый период (n = 1, l = 0) состоит из двух элементов H (1s1) и He (1s2).
Во втором периоде (n = 2, l = 0, 1) заполняются s- и p-орбитали от Li до Ne. Элементы называются соответсвенно s- и p-элементами.
В третьем периоде появляются пять d-орбиталей (n = 3, l = 0, 1, 2). Пока они вакантны, и третий период, как и второй, содержит восемь p-элементов от Na до Ar.
В четвертом периоде после десяти d-элементов появляются p-элементы от Ga (4s24p1) до Kr (4s24p6).
Пятый период повторяет четвертый – в нем также 18 элементов, и 4d-элементы, как и 3d, образуют вставную декаду (4d1–105s0–2).
В шестом периоде после лантана (5d16s2) – аналога скандия и иттрия, следуют 14 4f-элементов – лантаноидов.
Седьмой период отчасти повторяет шестой. 5f-элементов называются актиноидами. Их общая формула 5f2–146d0–17s2. Далее следуют еще 6 искусственно полученных 6d-элементов незавершенного седьмого периода.
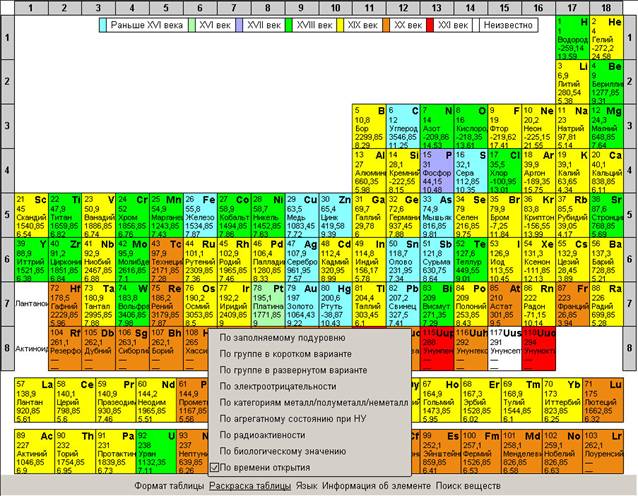
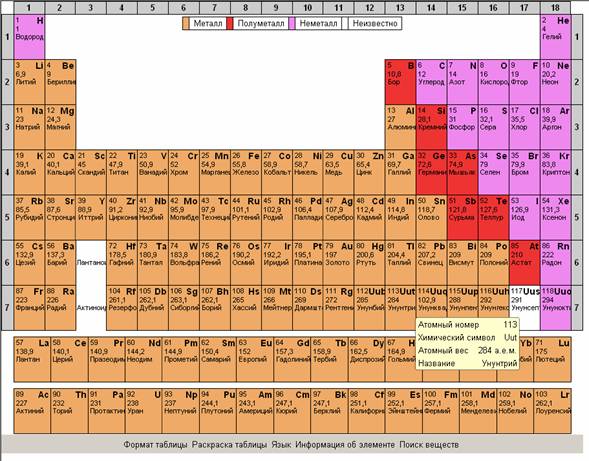
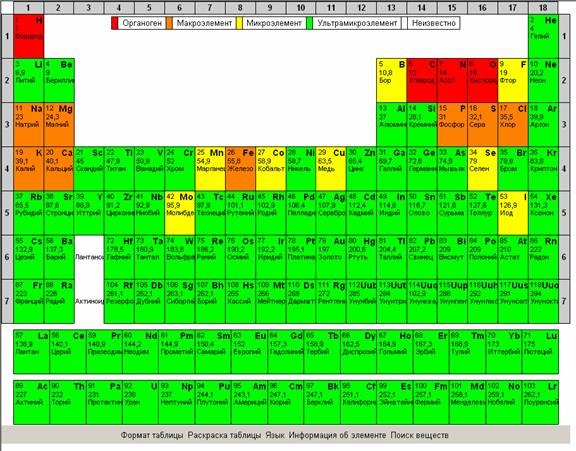
Рекомендуется показать все возможности интерактивной таблицы Менделеева, изменение раскраски таблицы для облегчения поиска веществ по подуровню, по группам элементов,
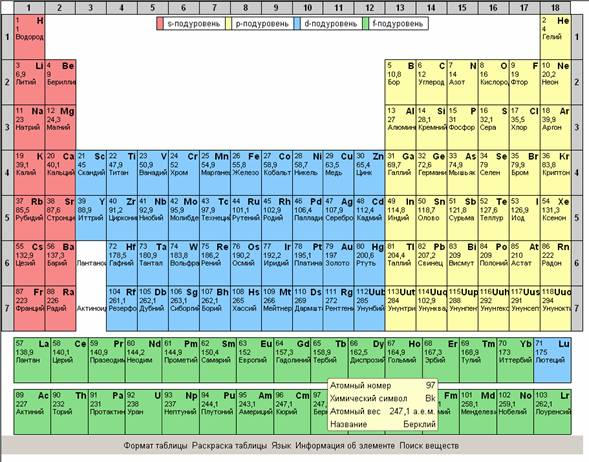
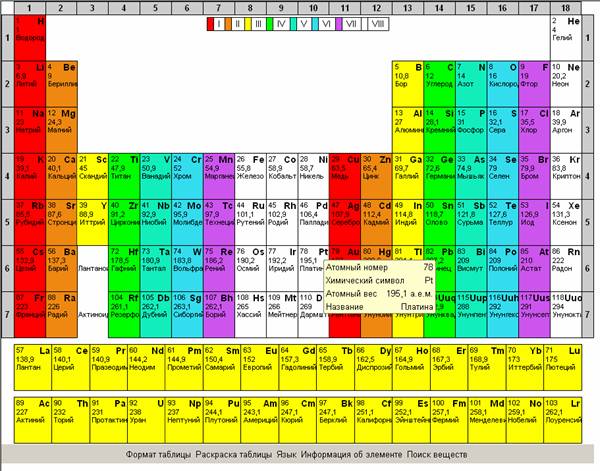
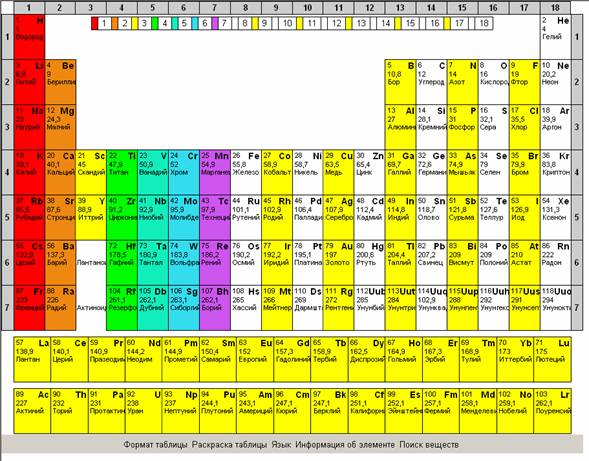

по степени металличности, по элементам, которые входят в состав органических веществ.
IV. Обобщение знаний. Формирование умений и навыков.
1. Система Д. И. Менделеева позволила не только предсказать существование неизвестных элементов, но и предугадать их свойства, исправить неверно определенные атомные массы уже известных элементов. Приведите примеры данных фактов.
2. Чем отличаются друг от друга различные формулировки периодического закона?
3. Какова современная формулировка периодического закона?
4. Какие закономерности изменения свойств элементов и их соединений наблюдаются в зависимости от положения элемента в Периодической системе химических элементов Д. И. Менделеева?
V. Первичная проверка усвоения знаний. Рефлексия
Для проверки усвоения знаний рекомендуется использовать тесты с использованием электронной модели «Периодическая система элементов». Ответы учащихся на тесты, показанные на интерактивной доске, рекомендуется сопровождать комментариями с помощью интерактивной модели ««Периодическая система элементов».
- Какое свойство химических элементов Д. И. Менделеев положил в основу их классификации?
a. Относительную атомную массу.
b. Строение внешних электронных слоев
c. Величину заряда ядра атома
d. Валентность элемента
- Свойства химического элемента определяются в первую очередь:
a. числом электронных уровней;
b. относительной атомной массой;
c. строением валентных энергетических уровней;
d. числом нейтронов в ядре.
- Каждый период, кроме первого, начинается:
a. со щелочно-земельного металла;
b. с инертного газа;
c. с галогена;
d. со щелочного металла.
- Каждый период завершается:
a. щелочным металлом;
b. щелочноземельным металлом;
c. галогеном;
d. инертным газом.
- Как по периодической системе определить, в главной или побочной подгруппе находится элемент? Элемент находится в главной подгруппе, если:
a. он расположен в одной подгруппе с элементом второго периода;
b. это s- или p-элемент;
c. в этой подгруппе больше элементов, чем в другой подгруппе этой группы;
d. все предыдущие ответы верны.
- Какое из перечисленных свойств элемента изменяется периодически с увеличением заряда ядра атома?
a. Относительная атомная масса.
b. Строение внешних электронных слоев.
c. Число протонов в ядре.
d. Число энергетических уровней.
- С возрастанием порядкового номера элемента периодически повторяется:
a. заряд ядра атома;
b. химические свойства элемента;
c. общее число электронов;
d. число энергетических уровней.
- Какое утверждение из общей характеристики подгруппы галогенов неверно?
a. У атомов галогенов с увеличением порядкового номера возрастают радиус, восстановительные свойства и уменьшаются значения электроотрицательности.
b. Молекулы простых веществ, образованных галогенами, двухатомны и в ряду фтор – хлор – бром – иод возрастают плотность, интенсивность окраски, температура кипения и металлические свойства веществ.
c. Окислительные свойства галогенов с увеличением порядкового номера элементов возрастают, а восстановительные – убывают.
d. В ряду галогеноводородов фтороводород – хлороводород – бромоводород – иодоводород прочность молекул уменьшается, а кислотные свойства их растворов возрастают.
- Высшая степень окисления атомов в главной подгруппе с увеличением порядкового номера элемента (сверху вниз):
a. увеличивается;
b. уменьшается;
c. не изменяется;
d. изменяется периодически.
- Для элементов главных подгрупп номер группы в периодической системе равен числу:
a. энергетических уровней в атоме;
b. электронов на внешнем энергетическом уровне;
c. подуровней на внешнем энергетическом уровне;
d. электронов в атоме.
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
|
1
|
3
|
4
|
4
|
4
|
3
|
2
|
3
|
3
|
2
|